尽管手术和化疗取得了重大进展,但耐药性仍然是癌症治疗成功的障碍,也是该病死亡率高的原因。基因突变发现在一些涉及DNA修复、膜转移、自噬和线粒体功能障碍的信号通道中,但基因组改变并不能完全解释化学耐药性的复杂机制。翻译后修饰(PTM)在生理和病理过程中增加蛋白质的功能多样性。基于高分辨率质谱(MS)蛋白质组学的最新突破为确定各种生物体中的新型PTM铺平了道路,但对于新型赖氨酸(K)酰化修饰的生物学功能知之甚少。PTM显著提高了蛋白质的复杂性,但新赖氨酸酰化修饰的功能和确切机制尚不清楚。化疗耐药性仍然是成功治疗的一个艰巨挑战。
2023年7月18日,广州医科大学李斌在Cellll通讯 Discovery 在线发表题为“在线发表”Lysine butyrylation of HSP90 regulated by KAT8 and HDAC11 confers chemoresistance“研究论文,研究论文HSP90赖氨酸丁酰化产生化疗耐药性,由KAT8和HDAC11控制。这项研究发现赖氨酸丁酰化(Kbu)肿瘤细胞和组织在化疗耐药性方面具有特异性。HSP90中的赖氨酸754(HSP90K754)通过整合丁酰组图谱和功能获得/丧失实验,被认定为KBU的底物。Kbu修改导致食管鳞状细胞癌HSP90(ESCC)在复发样本中,过度表达和进一步增加。HSP90的增加有助于5-FU耐药性,并可预测癌症患者的不良预后。
就机制而言,HSP90 K754由KAT8和HDAC11作为写入器和擦拭器协调;SDCBP通过结合HDAC11的竞争力,提高HSP90的KBU水平和稳定性。此外,SDCBP可以用先导化合物V020-9974阻断HSP90 克服5-FU耐药性的K754构成了潜在的治疗策略。总之,研究表明,HSP90的K754丁酰化对5-FU的耐药性有显著贡献。SDCBP通过结合HDAC11的竞争力,调整HSP90的KBU修饰和稳定性。SDCBP-药理抑制与先导化合物相互作用的HSP90提供了克服化疗耐药性的潜在策略。

赖氨酸丁酰化(Kbu)它是一种存在于组蛋白和非组蛋白中的新型PTM。Kbu已被确定为真菌、植物和动物,但缺乏人类非组蛋白Kbu装饰的全球前景。更重要的是,负责Kbu沉积和清除人体内的写入器和擦拭器尚未被报道。在本研究中,与亲代细胞相比,在新确定的赖氨酸酰化装饰中,氟尿嘧啶(5-FU)耐药(FR)食管鳞状细胞癌(ESCC)只有Kbu的水平在细胞中发生了显著的变化,因此成为研究的焦点。在此,研究人员对5-FU耐药ESC细胞丁酰组的定量分析和功能研究表明,热休克蛋白90(HSP90)中赖氨酸754(K754)的KBU修饰对化疗耐药性有显著贡献,HSP90是一种高度保守的分子伴侣,参与信号转导和蛋白质降解。并研究了HSP90kbu的酰化酶和脱酰酶。
HSP90是调节300多个客户蛋白质稳定性和活性的重要分子伴侣蛋白,其中许多参与癌症的进展。据报道,磷酸化、乙酰化、SUMO化等几种PTM可以调节HSP90的活性,并根据客户蛋白质和细胞的需要进行微调。在这里,研究人员提供了第一个证据,证明HSP90Kbu修饰增强了其蛋白质稳定性,从而驱动癌细胞的化疗耐药性。PTM是一种动态和可逆的装饰,识别相应的写入器和擦除器对破译调节机制至关重要。虽然最近发现了两种乙酰转移酶CBP和P300催化组蛋白的KBU修饰8,但目前尚不清楚KBU沉积或去除非组蛋白中的酶。研究人员首次透露,KAT8是HSP90Kbu的写入器,HDAC11是HSP90KB的擦除器。不能排除其他写入物或擦除物的可能性。因此,有必要进一步详细研究,以确定这些酶如何共同发挥精细的调节作用。
为了研究新发现的赖氨酸酰化修饰对癌症化疗耐药性的影响,研究人员使用9个赖氨酸酰化pan抗体、2个赖氨酸和3个赖氨酸酰化pan抗体来比较他们之前建立的5-FU敏感/耐药ESCC细胞。研究人员注意到,5-FU的耐药性 在ESCC细胞中,只有KBU显著增加,而其他赖氨酸酰化修饰没有显著增加。目前尚不清楚KBU在癌症中的作用。在高分辨率液相色谱-串联质谱中绘制5-FU耐药细胞的丁酰组图(LC–MS/MS)在分析之前,用Kbu泛抗体偶联珠来丰富修饰肽。与亲本细胞相比,5-FU耐药细胞中的105个差异表达了Kbu蛋白(DEKPs)123个差异表示Kbu位点(DEKSs)。
亚细胞定位分析显示,近一半的DEKPs(46.08%)定位在细胞质中。接下来,对KBU位点两侧的氨基酸进行了检查,在KBU位点的-1和+1位置发现了带负电荷的氨基酸富集。此外,DEKS的聚类分析定义了四个不同的丁酰亚群(Q1、Q2、Q3和Q4)。Q1(<0.667和Q2(0.667)–0.769)亚组包括Kbu水平降低的修饰点,而Q3(1.3)–1.5)和Q4(>1.5)亚组包含Kbu水平增加的装饰点。基因本体论(GO)富集分析提示了DEKPS在化疗耐药性方面的可能功能。此外,蛋白质结构域的富集分析表明,DEKPS含有HSP90N端等多个功能结构域。
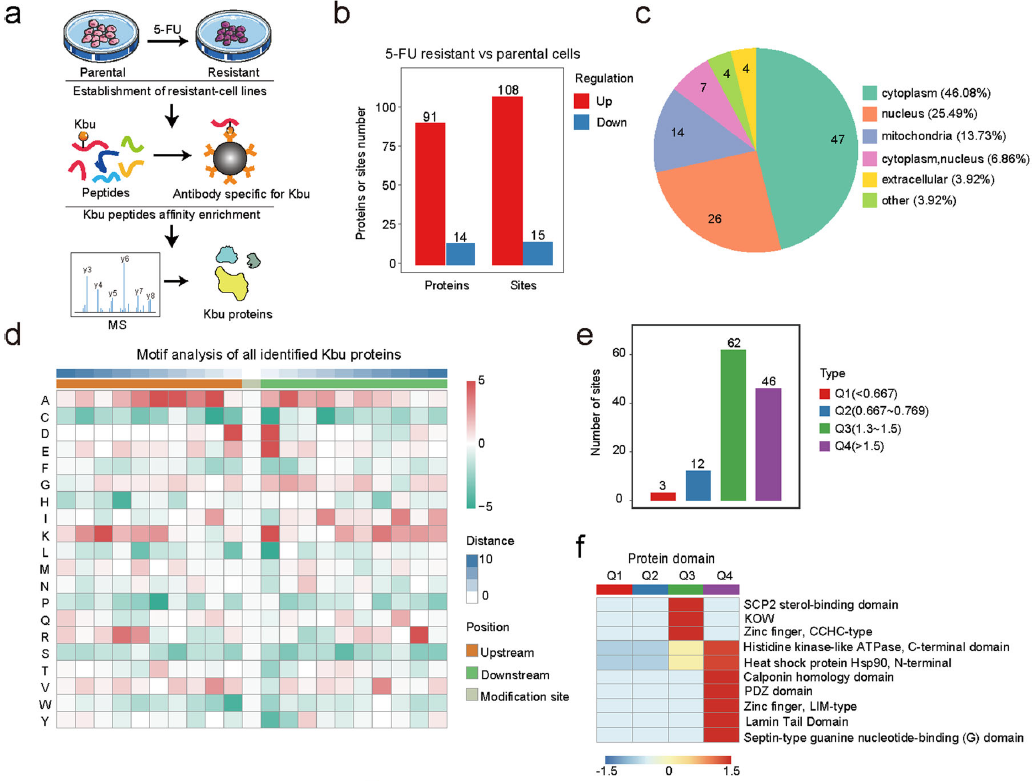
赖氨酸丁酰组在癌症化疗耐药性和Kbu修饰HSP90中的重要作用中的分布 Discovery )
本研究旨在揭示KBU在癌症中的生物学和临床意义,并筛选和验证赖氨酸乙酰转移酶8(KAT8)和组蛋白脱乙酰酶11(HDAC11)作为KBU的写入者和擦除者。该研究还确定了HSP90Kbu的修改是否由多配体聚糖与蛋白质相结合(SDCBP)通过竞争性蛋白质的组合进行调整。此外,用先导化合物抑制HSP90Kbu的药理学结果显示了克服化疗耐药性的潜在治疗策略。
原文链接:https://www.nature.com/articles/s41421-023-00570-y
(原标题:Cell Discov | 广州医科大学李斌团队发现了HSP90赖氨酸丁基化产生化学耐药性的新调节机制)
