目前尚不清楚癌细胞通过肿瘤免疫相互作用逃避T细胞介导的杀伤。树突状细胞(DCs),特别是1型常规树突状细胞(CDC1s),引导T细胞启动和治疗肿瘤。尽管其他信号尚未完全定义,但DC功能是由模型识别受体安排的。
营养物质是适应性免疫的新兴介质,但很大程度上还没有解决营养物质是否影响DC功能或先天性免疫细胞与适应性免疫细胞之间的通信。在这里,我们建立了谷氨酰胺作为细胞间代谢检查点,指示肿瘤- CDC1串扰并允许CDC1激活细胞毒性T细胞。通过增强CDC1介导的CD8,在肿瘤中补充谷氨酰胺+ T细胞免疫可以抑制肿瘤的生长,克服免疫疗法对检查点阻断和T细胞介导的抗性。在机制上,肿瘤细胞和CDC1s通过转运体SLC38A2竞争谷氨酰胺摄入,以调节抗肿瘤免疫。谷氨酰胺是促进CDC1功能的主要氨基酸。此外,谷氨酰胺信号通过FLCN影响TFEB功能。通过消除谷氨酰胺补充的抗肿瘤治疗作用,dc中FLCN的缺失可以选择性地损害体内CDC1的功能,表现为SLC38A2缺陷。我们的研究结果证实,谷氨酰胺介导的肿瘤细胞与CDC1s之间的代谢串扰是肿瘤免疫逃避的基础,并揭示了CDC1s中的谷氨酰胺获取和信号传导是DC激活的限制和癌症治疗的假设目标。

https://www.nature.com/articles/s41586-023-06299-8
研究背景
01
营养物质塑造免疫细胞功能和亚群分化,但我们对不同组织微环境中营养介导的免疫反应的理解有限。肿瘤微环境中营养和代谢物的变化(TME)并影响肿瘤与免疫的相互作用。例如,葡萄糖或氨基酸组成的变化会导致T细胞效应功能障碍或髓细胞活性障碍。在TME中,DC捕获并提供与肿瘤相关的抗原,并提供共同的刺激信号和可溶性因子,以刺激抗肿瘤免疫。DC在感知环境信号时被激活,包括垂死肿瘤细胞的信号。然而,尽管细胞代谢途径在引导DCS的静止和激活中发挥了新的作用,但营养物质或代谢过程以及如何调节DC的功能和异质性,特别是在TME中,仍然很大程度上是未知的。
CDCs包括CDC1和CDC2亚群,分别促进CD8+细胞毒性T细胞和CD4+ T细胞启动。CDC1s也与细胞毒性CD8有关+ T细胞交叉呈现,促进抗肿瘤免疫。此外,CDC1s有助于阻断免疫检查点(ICB)成功治疗过继性T细胞(ACT)。然而,由于DC功能活性受损,免疫抑制的TME部分是由不平衡的丰富性或对局部环境线索的感知引起的。模式识别受体和其他受体系统感知DC亚群功能特化的环境信号,但营养物质和代谢物在很大程度上不清楚,特别是与淋巴细胞相比。对于有效的癌症免疫治疗,在TME中介导DC功能或功能障碍的机制至关重要。
研究结果
02
开始CDC1s肿瘤免疫的谷氨酰胺
为了检测TME中的营养成分,我们从MC38结肠腺癌细胞或B16F10表达 (B16-OVA)肿瘤间质液分离在黑色素瘤细胞的小鼠中(TIF)与血浆匹配,并进行代谢组学分析。葡萄糖、谷氨酰胺、精氨酸和半胱氨酸(或半胱氨酸)低于匹配血浆。谷氨酰胺的减少特别有趣,因为谷氨酰胺代谢的药物阻断或肿瘤细胞中缺乏谷氨酰胺酶会抑制癌细胞的生长,增强CD8+ 抗肿瘤活性T细胞。然而,谷氨酰胺酶抑制也会损害TME23CD8+ T细胞的活化和抗肿瘤能力。在上述观察的基础上,我们测试了谷氨酰胺在肿瘤中的丰度是否会影响抗肿瘤免疫。每天在B16-OVA荷瘤小鼠肿瘤中注射谷氨酰胺可以提高TIF中的谷氨酰胺水平。值得注意的是,在MC38或B16-OVA肿瘤细胞攻击的野生小鼠中,这种治疗降低了肿瘤的生长和重量,但在Rag1中 - / -小鼠中没有,这表明适应性免疫在介导谷氨酰胺抗肿瘤作用中的重要性。
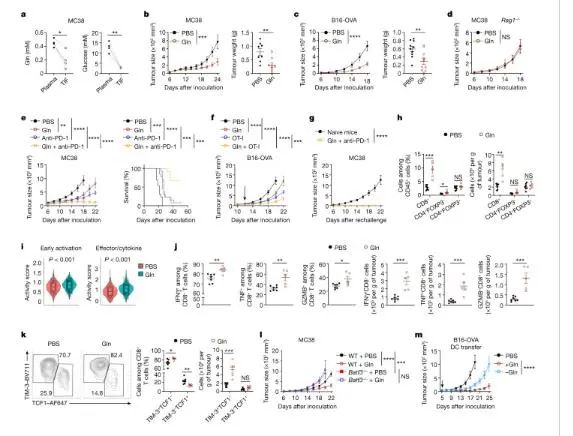
在肿瘤中补充谷氨酰胺可促进CDC1介导的抗肿瘤免疫
值得注意的是,Batf3缺少CDC1s29 - / -在老鼠中,补充谷氨酰胺不会影响MC38和B16-OVA肿瘤的生长,这表明CDC1s是治疗谷氨酰胺的有益效果。为了测试谷氨酰胺是否会影响CDC1介导的疫苗效果,我们使用DC转移模型,将脾CDC1与OVA和聚I放在足够或缺乏谷氨酰胺的培养基中:用于肿瘤治疗的C脉冲注射到B16-OVA小鼠体内。谷氨酰胺缺乏的培养基中,CDC1s脉冲显示出受损的治疗效果。因此,谷氨酰胺对于内源性和过继转移的CDC1s的抗肿瘤活性是必要的和有限的,这表明谷氨酰胺和CDC1s在抗肿瘤免疫中相互作用。
为了探索潜在的机制,我们首先使用荧光蛋白Zsgren来表达荧光蛋白 (B16-ZsGreen)31B16F10肿瘤细胞评估了肿瘤中谷氨酰胺的补充是否会影响DC向肿瘤引流淋巴结(dLNs)的迁移。在补充谷氨酰胺后,ZsGren+在肿瘤dln中迁移DC的百分比和ZsGren在肿瘤中的百分比+ DC的百分比没有改变,表明对DC肿瘤抗原摄入或迁移能力缺乏影响。为了确定肿瘤dln中的交叉启动是否发生变化,MC38-OVA荷瘤小鼠用谷氨酰胺治疗,羧氟蛋白琥珀酰酯(CFSE)标记的初始OT-I细胞过代转移,增殖评估显示无损伤。因此,在肿瘤DLN中补充谷氨酰胺初始CD8+ T细胞启动没有影响。对CD8的影响进行评估+ T细胞对TME中抗原再刺激的反应能力,我们过继地将激活的OT-I细胞转移到B16-OVA荷瘤小鼠中,并对TME中的激活进行评估。OT-I细胞在谷氨酰胺处理的肿瘤中表现出更大的积累,也表明T-bet表达增加,颗粒酶B-或ifn - γ-与TNF共表达细胞的频率更高。一般来说,在肿瘤中补充谷氨酰胺会增强CD8+ T细胞在TME中的作用不影响DC迁移或初始CD8+ T细胞的启动。
SLC38A2决定肿瘤- 串扰cdc1
接下来,为了确定谷氨酰胺与其他氨基酸相比如何影响DC功能,我们进行了全面的营养筛选试验OT-II (ova特异性CD4+)细胞作为DC功能读数。谷氨酰胺剥夺CDC1s和CDC2s在较小程度上减少了OT-I或OT-IL-2或IFNγ的产生。同样,在FLT3L系统中培养的骨髓源性DC (bmdc)的CD8+ 谷氨酰胺耗尽后,T细胞启动受损。在对OVA257-264的反应中,谷氨酰胺缺失的CDC1s在促进OT-I细胞增殖方面也存在缺陷,虽然低于对OVA的反应,但这表明抗原交叉呈现的损伤更大。此外,谷氨酰胺缺失的CDC1s显示,单核增生李斯特菌表示热杀伤ova(hklc - ova)OT-I细胞交叉减少,表明CD8在CDC1介导下的谷氨酰胺+ T细胞的启动起着重要的作用。值得注意的是,谷氨酰胺饥饿持续3小时(所有体外试验的时间框架)对CDC1s和CDC2s的生存影响最小,尽管它会导致更多的死亡,这表明谷氨酰胺剥夺DC的缺陷T细胞启动并不是由于细胞死亡的增加。最后,我们用OVA脉冲将CDC1s或CDC2s添加到无氨基酸培养基中,然后与OT-I或OT-共同培养II细胞。单独补充谷氨酰胺使CDC1(和CDC2)依赖性T细胞增殖。因此,谷氨酰胺是支持DC功能介导T细胞启动的必要和充分条件,与CDC2s相比,在CDC1s中观察到了优先事项。

谷氨酰胺在肿瘤细胞和CDC1s之间的相互作用调节抗肿瘤免疫
为了确定SLC38A2在肿瘤细胞中介导肿瘤免疫相互作用的功能重要性,我们使用SGNTC-或SGSLC38a2转导的MC38或B16-OVA细胞刺激野生小鼠,发现SLC38A2缺失后肿瘤生长缓慢。因此,来自SLC38A2缺陷B16-OVA肿瘤的TIF中谷氨酰胺的丰度增加,而其他SLC38A2底物没有增加,进一步支持SLC38A2更有选择地引导谷氨酰胺的运输。MC38肿瘤中肿瘤内淋巴细胞对Sgslc38a2转导的分析表明,肿瘤内CD8+ T细胞的频率和数量更高,包括表达IFNγ、TNF或颗粒酶B的细胞表明效应表增强。为了测试SLC38A2是否以肿瘤固有的方式工作,我们仍然需要免疫系统来发挥其在Batf3中的作用 - / -或Rag1 - / -SLC38A2缺陷MC38肿瘤的生长在小鼠中被检测到。在这些小鼠中,有益的抗肿瘤作用被阻断,揭示了CDC1s和淋巴细胞的关键重要性。一般来说,这些结果表明,SLC38A2在肿瘤细胞中的缺乏显著损害了CDC1依赖的肿瘤生长。
SLC38A2在CDC1s中触发肿瘤免疫
为了检验SLC38A2的CDC1特异性表达是否足以控制肿瘤生长,我们生成XC1cre/+SLC38a2fl/fl小鼠,并在CDC1s38中特异性删除SLC38A2。MC38肿瘤在Xcr1cre/+Slc38a2fl/fl小鼠中生长增加,表明SLC38a2对CDC1s肿瘤控制的选择性要求。相比之下,Sgrna介导的Slc38a2缺失在表达cas9的OT-I细胞中,并不会损害其控制B16-OVA肿瘤生长的能力。基因缺失Slc38a2在MC38肿瘤模型的T细胞(CD4creSlc38a2fl/fl小鼠)中也取得了类似的结果。因此,DC而非T细胞需要SLC38A2来协调抗肿瘤免疫,这表明SLC38A2代表了谷氨酰胺获取与肿瘤免疫相互作用的竞争性检查点。
FLCN在CDC1s中介导肿瘤免疫
谷氨酰胺因其在癌细胞、T细胞和巨噬细胞中的代谢作用而受到广泛关注。谷氨酰胺对细胞内信号事件的影响尚未完全确定。在本文中,我们发现谷氨酰胺的可用性相互影响FLCN-FNIP2复合物的形成和TFEB活性,FLCN-TFEB轴介导谷氨酰胺向CDC1抗原呈现和效应物样CD8+ 激活T细胞反应。虽然FLCN抑制了TFEB的活性,但我们在CDC1s和体内抗肿瘤免疫中建立了谷氨酰胺和FLCN - TFEB信号通道之间以前没有被认识到的联系。值得注意的是,与F类似于LCN缺陷,SLC38A2缺陷消除了谷氨酰胺补充剂的抗肿瘤作用,从而建立了这种谷氨酰胺转运体和FLCN信号作为CDC1功能和肿瘤免疫的关键驱动因素。我们的工作为谷氨酰胺在DC中的免疫刺激提供了重要的见解,与脂质和2、3-双氧酶1介导的色氨酸分解代谢在肿瘤或炎症环境中调节DC功能的免疫抑制或耐受性相比。一般来说,靶向肿瘤中的谷氨酰胺水平或CDC1s中的谷氨酰胺依赖信号对改善癌症治疗和克服肿瘤介导免疫抑制具有重要意义。
参考资料:
https://www.nature.com/articles/s41586-023-06299-8
