胃癌是全球公共卫生面临的巨大挑战。世界上每年有100多万新的胃癌,其中近一半是中国患者。我国胃癌流行病学的重要特点是,超过三分之一的患者在就医时处于晚期病程,这些患者的五年生存率仅为5%左右,直接导致我国胃癌患者整体预后不佳。
近年来,随着化疗、靶向和免疫检查点抑制剂等多药物联合方案的逐步引入临床治疗策略,一些晚期胃癌患者的生存期有所改善,但大多数晚期和复发性胃癌患者的预后仍令人担忧。不可忽视的是,肿瘤和癌症基因组的图谱(TCGA)亚种癌症研究小组(ACRG)里程碑研究证实,胃癌具有高度的形态学、分子病理学和遗传异质性。特别是印戒细胞癌在晚期胃癌中所占比例逐年上升(Gastric signet ring cell carcinoma, GSRCC)更独特的免疫抑制、恶性进展和多种耐药机制,不仅给胃癌分子和免疫特征的澄清带来了巨大的困难,而且限制了精确和个性化治疗策略的临床应用。

针对上述严重的科学瓶颈,浙江大学医学院第二附属医院陈健、浙江大学医学院王清、MD安德森癌症中心梁韩联合成立了基于临床诊疗和基础研究的转型研究团队,重点探索和分析以GSRCC为典型代表的胃癌高异质特征。研究团队通过SCRNA-seq、Cytof和多通道荧光全景成像描绘了胃癌免疫微环境特征图,首次揭示了CXCL13和CD8+T细胞来源的成熟三级淋巴结构(Tertiary lymphoid structures, TLSs)缺失是GSRCC免疫治疗低响应的关键原因。这一发现对阐明胃癌异质性特征具有重要的科研意义,具有广阔的临床转化应用前景。2023年6月,Gastroenterology杂志发表了上述研究成果。

图1. CXCL13来源于CD8-Tex,是胃癌免疫微环境的重要调节机制

图2. 研究方案
通过免疫靶向单细胞分析策略,共招募32例不同病理类型的晚期胃癌患者,探索肿瘤相关免疫微环境特征。消耗性CD8的研究发现+T(CD8-Tex)调节性T细胞和免疫抑制(Treg)细胞富集是胃癌免疫微环境的重要特征。不同的基因筛选证实了与活性和效应相关的基因(如IFNG)、EGR1)、抑制性免疫检查点分子(HAVCR2、PDCD1、LAG3、CTLA4、TIGIT)CXCL13在GSRCCCD8-Tex细胞中的表达水平显著下降。
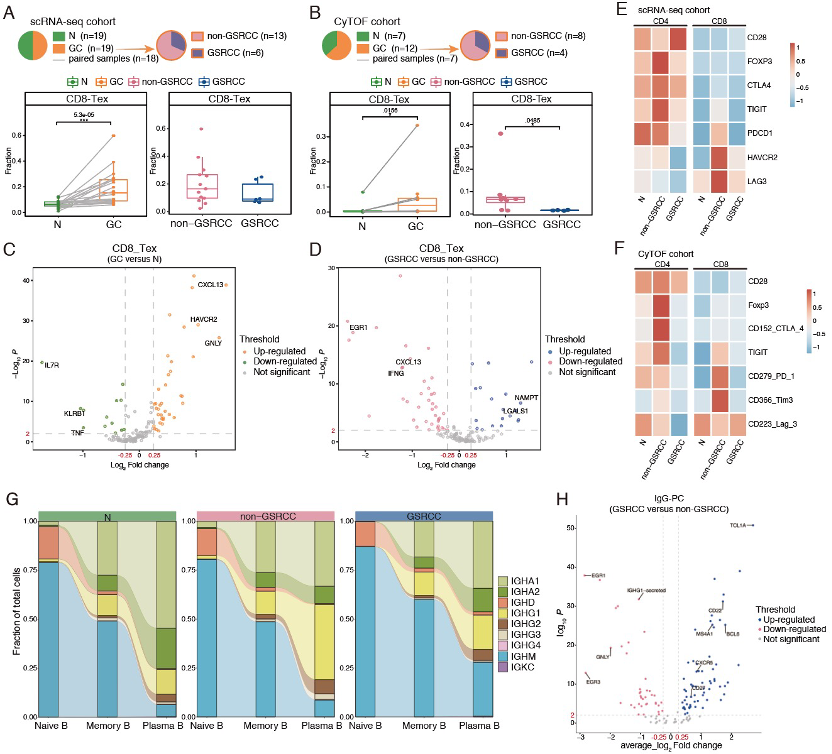
图2. GSRCC和non-特征性免疫细胞在GSRCC中亚群差异
根据单细胞TCR和BCR的测序结果,GSRCC中显著抑制了CD4+和CD8+T细胞克隆扩展能力和TCR共享能力;IGG浆细胞分化能力减弱,BCR高频突变(somatic hypermitation, SHM)对肿瘤抗原亲和力的降低表明B细胞的免疫活性降低。这些结果表明,GSRCC的免疫“沉默”状态主要是由T组成的、B细胞克隆扩张受抑,细胞分化/转化受阻。

图3. 在GSRCC中T、B细胞分化和功能异常
为了进一步阐明以GSRCC为代表的胃癌免疫治疗的低响应性,研究团队通过细胞通信分析发现,GSRCC细胞间相互作用的数量和强度显著降低,而Treg、趋化因子CXCL13是Th17、CD8-Tex等亚群的共同主要分泌信号。CXCL13已被以往的研究证实来自Tfh和特定的CD8+T细胞,在滤泡结构、生发中心响应和正常体液免疫功能维持方面发挥着关键作用,也被认为与特定肿瘤T细胞的耗尽状态和免疫检查点疗法的响应密切相关。近年来,CXCL13被证明是三级淋巴结构(Tertiary lymphoid structures, TLSs)形成的关键因素和典型的分子标志。通过多通道荧光全景成像发现non-GSRCC中存在大量T、由B细胞组装而成的TLSS和CD4+、CD8+T细胞(包括高表达PD-1的CD8-Tex细胞)均表达CXCL13,而免疫细胞聚集灶在GSRCC中很少观察到。

图5. GSRCC和non-GSRCC免疫微环境差异
综上所述,本研究阐明了以GSRCC为代表的胃癌高度异质性免疫特征图谱,并提示免疫细胞克隆和分化功能抑制导致GSRCC免疫“沉默”状态。进一步的功能分析表明,CXCL13可能通过影响三级淋巴结构的形成和成熟,在胃癌免疫微环境调节中发挥重要作用。该研究结果阐明了胃癌分子的免疫特征,并表明以CXCL13为病理分层标志的综合治疗策略具有广阔的临床应用前景。

浙江大学医学院第二附属医院胃肠外科博士生陈静、浙江大学基础医学院免疫研究所博士生刘迅、美国MD安德森癌症研究中心博士生罗伊凯是该论文的共同第一作者。浙江大学医学院第二附属医院胃肠外科教授陈健、浙江大学基础医学院免疫研究所王清教授、美国MD安德森癌症研究中心梁汉教授是该论文的共同沟通作者。本研究由浙江省重点研发计划项目资助。
